
Schützen Sie Ihre Patienten vor Aorteninsuffizienz
Schnelle Überweisung kann Ergebnisse und Überleben verbessern

Wie viele Menschen in Europa leben schätzungsweise mit AI?1,2
Verzögerte Überweisungen zur Klappenoperation können sich auf die Therapieergebnisse auswirken und die Überlebenszeit von Patienten mit Aorteninsuffizienz (AI) verringern. 3 Leitlinien betonen, dass die Patienten frühzeitig zur umfassenden Abklärung überwiesen werden sollten, bevor es zu irreversiblen Schäden kommt. 4 Durch eine frühzeitige Überweisung können die Patienten erfolgreich chirurgisch behandelt werden.3

der Allgemeinbevölkerung sind von AI betroffen1

der Allgemeinbevölkerung sind von Aortenstenose (AS) betroffen1

Menschen in Europa könnten mit AI leben1,2
Bei den unter 65-Jährigen ist AI verbreiteter als AS (AI 0,1 %–0,7 % versus AS 0,02 %–0,2 %).1
Rund 50 % der Menschen im Alter > 65 Jahren haben eine mindestens leichte unerkannte Herzklappenerkrankung (VHD), und die Anzahl an Menschen mit klinisch relevanter VHD, einschließlich AI, wird im Laufe der nächsten 50 Jahre mit der zunehmend alternden Bevölkerung voraussichtlich erheblich zunehmen.5
Die ESC/EACTS-Leitlinien von 2021 zum Management von Herzklappenerkrankungen (VHD) betonen, dass die Patienten frühzeitig zur umfassenden Abklärung überwiesen werden sollten, bevor es zu irreversiblen Schäden kommt.4
Die Patienten müssen unverzüglich an das Herzteam zur Beurteilung der chirurgischen Therapie überwiesen werden.4
.png)
In einer retrospektiven Studie in den USA unter Verwendung der elektronischen Gesundheitsakten von 4.608 Patienten mit symptomatischer schwerer AI zeigten Patienten, die einer chirurgischen Intervention zur Behandlung der AI unterzogen wurden, ein verbessertes Überleben im Vergleich zu Patienten ohne chirurgische Intervention.3
Relative Risikoreduktion von 62 % in Bezug auf das Risiko der 1-Jahres-Mortalität bei Patienten, die innerhalb 1 Jahres nach der Diagnose keinen SAVR erhielten (Mortalität: 24 %) verglichen mit Patienten, die einen SAVR erhielten (Mortalität: 9 %).3

Eine frühzeitige Diagnose kann schwierig sein, da augenfällige Symptome wie Angina pectoris und Kurzatmigkeit meist erst nach dem optimalen Zeitpunkt für eine Intervention auftreten.6,7
Bei Patienten mit erworbener AI erfolgt die Überweisung manchmal verzögert aufgrund einer unsachgemäßen Beurteilung der Symptome des Patienten und des Schweregrades seiner Erkrankung.8
Zur Abklärung einer Aorteninsuffizienz reicht ein einziger Messwert oder Doppler-Parameter nicht aus; es müssen mehrere Parameter integriert werden.9 Um zum Beispiel eine schwere AI gemäß den Kriterien der ESC/EACTS-Leitlinien 2021 zu erkennen, muss die Abklärung qualitative, semiquantitative und quantitative Parameter umfassen.4
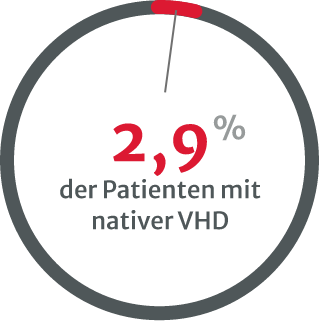
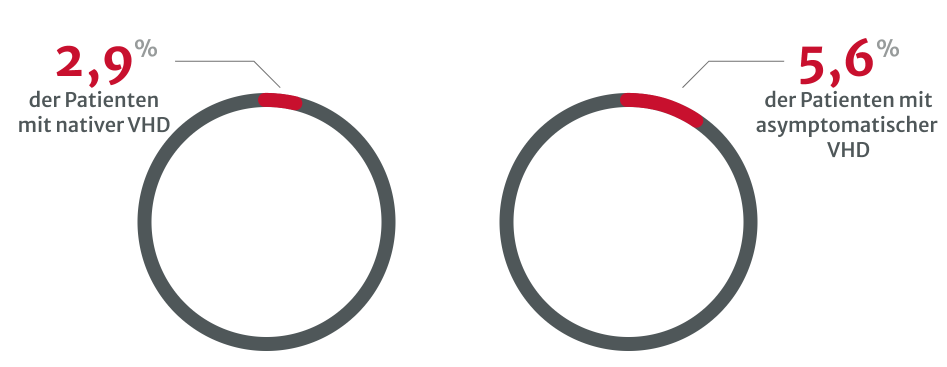
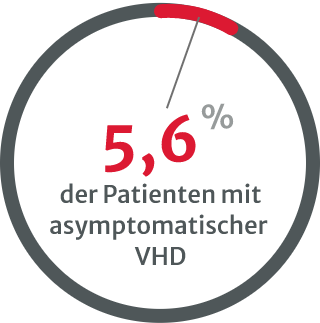
Belastungstests werden immer seltener durchgeführt, besonders
bei asymptomatischen Patienten mit schwerer nativer VHD.8
Für Patienten mit unbehandelter schwerer AI ist die Prognose schlecht. Dies schließt eine erhöhte Mortalität ein.3
AI-Patienten können unter einer Abnahme der funktionellen kardiovaskulären Gesundheit leiden.10 Bei konservativer Behandlung führt eine mittelschwere bis schwere AI zu einer 5-Jahres- und 10-Jahres-Mortalität von 25 % bzw. 50 %.10
Eine mittelschwere bis schwere AI verläuft meist innerhalb von 4 Jahren nach Beginn der Angina pectoris und innerhalb von 2 Jahren nach Beginn der Herzinsuffizienz tödlich.10
Eine verzögerte Überweisung kann bedeuten, dass die Patienten nicht mehr vollständig von einer Operation profitieren.11

In einer retrospektiven Studie in den USA unter Verwendung der elektronischen Gesundheitsakten von 4.608 Patienten mit symptomatischer schwerer AI. Das Mortalitätsrisiko erwies sich als 2,7-mal höher bei symptomatischen Patienten mit schwerer AI, die keiner Operation unterzogen wurden, verglichen mit Patienten, die innerhalb eines Jahres nach der Diagnose einen SAVR erhielten (p < 0,0001).3
In derselben Studie war der erstbehandelnde Kardiologe des Patienten eine starke Determinante der Wahrscheinlichkeit, einen SAVR zu erhalten, auch nach Bereinigung um potenzielle Confounder. Es zeigte sich, dass Kardiologen mit höheren SAVR-Raten ein besseres 1-Jahres-Überleben für ihre Patienten mit schwerer symptomatischer AI erreichten. Die Beseitigung dieser Variabilität in der Therapie könnte die Therapieergebnisse der Patienten verbessern.3

In einer retrospektiven Studie in den USA unter Verwendung der elektronischen Gesundheitsakten von 4.608 Patienten mit symptomatischer schwerer AI zeigten Patienten, die innerhalb eines Jahres nach der Diagnose einem chirurgischen Aortenklappenersatz (SAVR) zur Behandlung der AI unterzogen wurden, ein verbessertes Überleben im Vergleich zu symptomatischen Patienten mit schwerer AI ohne chirurgische Intervention, deren Mortalitätsrisiko sich als 2,7-mal höher erwies (p < 0,0001).3
In derselben Studie war der erstbehandelnde Kardiologe des Patienten eine starke Determinante der Wahrscheinlichkeit, einen SAVR zu erhalten, auch nach Bereinigung um potenzielle Confounder. Es zeigte sich, dass Kardiologen mit höheren SAVR-Raten ein besseres 1-Jahres-Überleben für ihre Patienten mit schwerer symptomatischer AI erreichten. Die Beseitigung dieser Variabilität in der Therapie könnte die Therapieergebnisse der Patienten verbessern.3
Die ESC/EACTS-Leitlinien 2021 stützen sich auf Studien, die verbesserte Überlebensergebnisse bei frühzeitigerer chirurgischer Intervention zeigen.6,7,12
In einer Studie auf Basis der ESC/EACTS-Leitlinien 2017 zu VHD zeigte sich ein besseres 10-Jahres-Überleben, wenn die AI vor den in den Leitlinien definierten Triggern im asymptomatischen Stadium behandelt wurde (operierte Patienten mit Klasse-I-Indikation gemäß den Leitlinien: n = 204, mit Klasse IIa und IIb: n = 66, vor den in den Leitlinien definierten Triggern: n = 86).7 Eine weitere Studie auf Basis einer früheren Version der ACC/AHA-Leitlinien von 2014 zeigte bessere postoperative Ergebnisse bei Patienten, die mit weniger schweren Symptomen operiert wurden, verglichen mit Patienten, die auf die in den Leitlinien definierten Trigger warteten (operierte Patienten mit Klasse-I-Indikation: n = 284, Klasse II: n = 50, vor den in den Leitlinien definierten Trigger: n=27).6
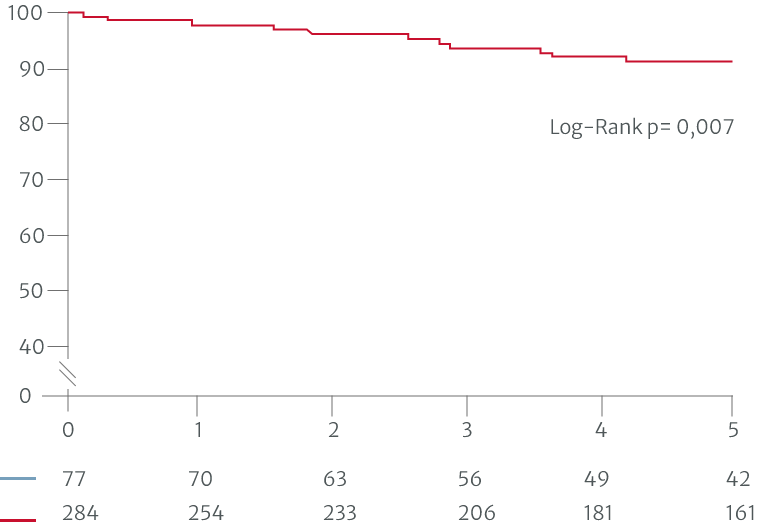
Patienten mit Nicht-Klasse-I-Indikationen für die Operation hatten ein besseres postoperatives Überleben.6
Adaptiert nach Yang LT et al. 2019
Patienten mit Nicht-Klasse-I-Indikationen für die Operation hatten ein besseres postoperatives Überleben.6
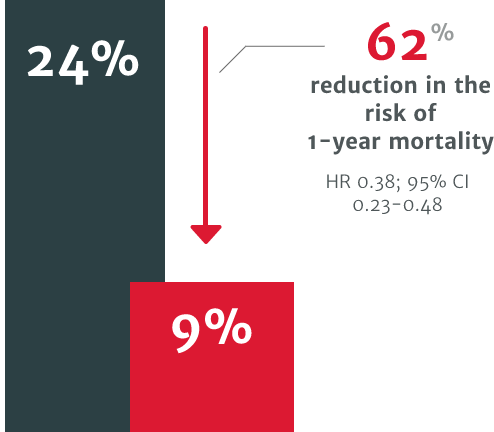
Relative Risikoreduktion von 62 % in Bezug auf das Risiko der 1-Jahres-Mortalität bei Patienten, die innerhalb 1 Jahres nach der Diagnose keinen SAVR erhielten (Mortalität: 24 %) verglichen mit Patienten, die einen SAVR erhielten (Mortalität: 9 %)3
In einer retrospektiven Studie in den USA, in der die elektronischen Gesundheitsakten von 4.608 symptomatischen Patienten mit schwerer AI verwendet wurden, zeigten Patienten, die einem chirurgischen Eingriff zur Behandlung der AI unterzogen wurden, eine bessere Überlebensrate als Patienten, bei denen kein Eingriff vorgenommen wurde.3
Relative Risikoreduktion von 62 % in Bezug auf das Risiko der 1-Jahres-Mortalität bei Patienten, die innerhalb 1 Jahres nach der Diagnose keinen SAVR erhielten (Mortalität: 24 %) verglichen mit Patienten, die einen SAVR erhielten (Mortalität: 9 %).3
Die ESC/EACTS-Leitlinien 2021 empfehlen einen SAVR als Standardintervention bei symptomatischer schwerer AI (Klasse Ib); diese Empfehlung stützt sich auf mehrere Studien.4 Eine Aortenklappenreparatur kann bei ausgewählten Patienten an erfahrenen Zentren in Betracht gezogen werden, wenn dauerhafte Ergebnisse zu erwarten sind (Klasse IIb).4 Dieselben Leitlinien empfehlen, dass eine TAVI in erfahrenen Zentren bei ausgewählten AI-Patienten, die für einen SAVR nicht in Frage kommen, erwogen werden kann.4

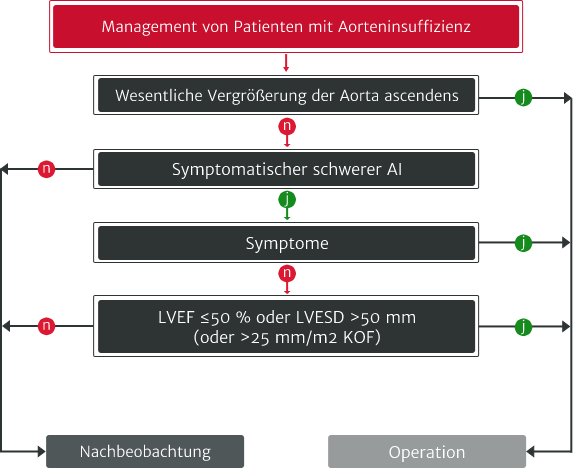
Adaptiert nach Vahanian A et al. 2021.
Die verschiedenen Möglichkeiten, die Therapieergebnisse bei Patienten mit AI zu verbessern, reichen von regelmäßiger Überwachung bis zu frühzeitiger Überweisung.4,8

Die Unterdiagnose von VHDs ist ein klares Problem und könnte damit zusammenhängen, dass zu wenige Belastungstests durchgeführt werden, insbesondere bei asymptomatischen Patienten mit schwerer nativer VHD.8 Mehrere Arten von Untersuchungen sind erforderlich, vor allem wenn die körperliche Untersuchung und die initialen nichtinvasiven Tests widersprüchlich sind.13

Weitere Untersuchungen und regelmäßige Überwachung können helfen, den Schweregrad der Erkrankung festzustellen, um diejenigen Patienten zu identifizieren, die eine Intervention benötigen.4,13 Die VHD II Erhebung 2017 ergab allerdings, dass nur bei sehr wenigen asymptomatischen VHD-Patienten ein Belastungstest durchgeführt wird.8

Die kardiale Magnetresonanztomographie (CMR) wird zwar immer häufiger zur Abklärung einer VHD eingesetzt, doch weniger als 10 % der Patienten werden auf diese Weise untersucht.8

Neue, empfindlichere Marker der linksventrikulären Dysfunktion, wie z. B. der globale longitudinale Strain des linken Ventrikels, werden zurzeit erforscht. In mehreren Fachartikeln ist die potenzielle Rolle neuerer Indizes wie linksventrikulärer longitudinaler Strain, Gewebedoppler und Torsion untersucht worden.14
Die ESC/EACTS-Leitlinien 2021 stützen sich auf Studien, die verbesserte Überlebensergebnisse bei frühzeitigerer chirurgischer Intervention zeigen.6,7,12
Die ESC/EACTS-Leitlinien 2021 stützen sich auf Studien, die verbesserte Überlebensergebnisse bei frühzeitigerer chirurgischer Intervention zeigen.6,7,12
Die AI-Podcasts von Edwards Lifesciences sind eine Podcast-Serie mit einigen der renommiertesten Herzspezialisten aus ganz Europa, die über die Unterdiagnose und die Unterbehandlung der Aorteninsuffizienz sprechen. Sie erörtern die bewährte Praxis und machen Vorschläge, wie der Therapiestandard verbessert werden kann.
Um auf dem Laufenden zu bleiben, sollten Sie unsere Podcast-Serie über die Definition, Diagnose und Behandlung von AI nicht verpassen.

AI: Aorteninsuffizienz (Aortenregurgitation), AS: Aortenstenose, SAVR: chirurgischer Aortenklappenersatz, KOF: Körperoberfläche, KI: Konfidenzintervall, CMR: kardiale Magnetresonanztomografie, EACTS: European Association for Cardio-Thoracic Surgery, ESC: European Society of Cardiology, LV: linksventrikulär/linker Ventrikel, LVEF: linksventrikuläre Auswurffraktion, LVESD: linksventrikulärer enddiastolischer Durchmesser, VHD: Herzklappenerkrankung.